Công thức tính nồng độ tỷ lệ là dạng đo lường và tính toán đã được học trong chương trình Hóa học tập ở cấp cho trung học cơ sở. Tuy nhiên, trong cuộc sống cũng như các bước hàng ngày thì cách làm này số đông được họ áp dụng thường xuyên.
Nước sạch tất cả thật sự “sạch”, QUÁ tởm HÃI với hầu như hình ảnh thực tế đằng sau
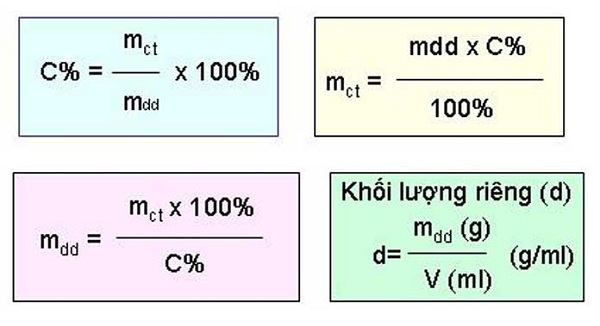
Công thức tính mật độ phần trăm
1. Nồng độ xác suất là gì?
Nồng độ xác suất (C%) của một hỗn hợp là nồng độ diễn đạt cho ta biết số gam hóa học tan tất cả trong 100 gam dung dịch.
Bạn đang xem: Công thức tính m chất tan

Công thức tính nồng độ phần trăm được sử dụng không hề ít trong hóa học
2. Cách tính nồng độ phần trăm
C% = mct/cdd.100%
Trong đó:
C%: độ đậm đặc phần trăm
mct: trọng lượng chất tan
mdd: khối lượng dung dịch ( mdd= m dung môi + m chất tan).
Các bí quyết suy ra từ phương pháp tính mật độ phần trăm
Công thức tính cân nặng chất tan: mct = (C%*mdd)/100%
Công thức tính trọng lượng dung dịch: mdd = (mct*100%)/C%
MỜI BẠN THAM KHẢO DANH SÁCH MÁY LỌC NƯỚC GIÁ RẺ VÀ CHẤT LƯỢNG NHẤT TRÊN THỊ TRƯỜNG
3. Bài tập vận dụng tính phương pháp nồng độ phần trăm (C%)
Ví dụ 1: hòa hợp 10 gam con đường vào 40 gam nước. Hãy tính nồng độ xác suất của hỗn hợp thu được.
-Tính cân nặng của dung dịch
Ta có: mdd= mdm + mct = 10+ 40= 50 gam (mdm là khối lượng dung môi)
-Nồng độ phần trăm:
C%= mct/mdd. 100%= (10/50).100%= 20%
Ví dụ 2: cho dung dịch H2SO4 tất cả nồng độ 28%. Tính trọng lượng H2SO4 bao gồm trong 300 gam dung dịch.
– trọng lượng của H2SO4 có trong 300 gam dung dịch:
m = (28 x 300)/100 = 84 (gam)
Công thức tính nồng độ phần trăm đơn giản, dế hiểu
Công thức tính mật độ mol của dung dịch (Cm)
Nồng độ Mol là khái niệm thân quen với bọn chúng ta
1. Tư tưởng nồng độ mol
Nồng độ mol (CM) của hỗn hợp là đại lượng mang đến ta biết số mol chất tan có trong 1 lít dung dịch.
2. Bí quyết tính nồng độ mol
CM = n/V (đơn vị: mol/l)
Trong đó:
n: số mol chất tanV: thể tích dung dịch (lít)Đơn vị mol/l còn được viết là M.
Từ phương pháp tính nồng độ xác suất của dung dịch ta rất có thể suy ra một loạt các công thức sau:
Số mol hóa học tan: n = cm . Vdd ( mol)
Thể tích dung dịch: Vdd= n
Cm( lít)
Qùa khuyến mãi ebook miễn giá tiền – 100 câu hỏi – đáp về nước và kinh nghiệm xương máu có tác dụng sạch nguồn nước. Để nhấn được không thiếu thốn ebook này, công ty chúng tôi muốn mời các bạn đăng ký thông tin của mình bằng cách điền vào mẫu đăng ký dưới đây. Đăng cam kết là hoàn toàn miễn chi phí và nhanh chóng
Đăng ký là hoàn toàn miễn mức giá và cấp tốc chóng

3. Một số trong những bài tập vận dụng
– ví dụ : vào 250 ml dd bao gồm hòa rã 16g Cu
SO4. Tính mật độ mol của dung dịch trên.
⇒ Số mol Cu
SO4 trong dung dịch là:
n
Cu
SO4 = 16/160 = 0,1 (mol)
⇒ độ đậm đặc mol của hỗn hợp Cu
SO4 là:
CM = 0,1/0,25 = 0,4 (mol/l)
Công thức tính độ đậm đặc phần trăm được áp dụng nhiều trong việc phân tích các công thức, phản bội ứng hóa học. Cố được các công thức này không những giúp ích cho họ trong công việc mà còn vào cuộc sống, học tập sản phẩm ngày.
MỜI BẠN THAM KHẢO DANH SÁCH MÁY LỌC NƯỚC GIÁ RẺ VÀ CHẤT LƯỢNG NHẤT TRÊN THỊ TRƯỜNG
Trong môn hóa học, nồng độ phần trăm, nồng độ mol của dung dịch là phần kiến thức cơ bản nhưng vô cùng đặc biệt mà học viên cần phải nắm vững để rất có thể giải được những bài toán. Vậy công thức tính độ đậm đặc phần trăm như thế nào là chuẩn nhất và vận dụng chúng như thế nào vào việc giải bài tập? Hãy cũng cùng eivonline.edu.vn đi tìm hiểu nội dung bài viêt dưới đây nhé!
1. Nồng độ dung dịch là gì?
Nồng độ dung dịch là khái niệm cho thấy lượng chất tan trong một lượng dung dịch duy nhất định. Nồng độ hoàn toàn có thể tăng bằng cách giảm lượng dung môi hoặc thêm hóa học tan vào dung dịch. Và ngược lại, có thê bớt nồng độ bằng phương pháp giảm lượng hóa học tan hoặc tăng thêm dung môi. Dung dịch call là bão hòa khi hỗn hợp đó không thể hòa tan thêm hóa học tan, sẽ là lúc dung dịch tất cả nồng chiều cao nhất.
2. Nồng độ xác suất là gì?
Trong hóa học, nồng độ xác suất của dung dịch được kí hiệu là C% đến ta biết số gam hóa học tan tất cả trong 100 gam dung dịch là bao nhiêu.

Nồng độ xác suất của một hóa học là gì
3. Cách làm tính mật độ phần trăm

Công thức tính nồng độ phần trăm của một chất
Công thức tính nồng độ xác suất như sau:
C% = mct/mdd x 100%
Trong đó:
C%: nồng độ phần trămmct: cân nặng chất tanmdd: trọng lượng chất tanMặt khác: mdd = mct + mdm (mdm là cân nặng của dung môi)
4. Cách thực hiện công thức tính nồng độ phần trăm
Đối với hóa học thì có không ít các dạng bài tập không giống nhau, có bài bác yêu cầu tính số mol, khối lượng, hay dễ dàng và đơn giản là xác định công thức chất hóa học của từng chất,… nếu như đề bài xích yêu ước tính nồng độ xác suất (C%) các chất tất cả trong dung dịch sau làm phản ứng thì bọn họ cần nên thực hiện công việc sau:
Bước 1: xác minh số chất tất cả trong dung dịch (đặc biệt lưu ý đến số dư của các chất gia nhập phản ứng)Bước 2: xác định trọng lượng dung dịch sau khi tham gia phản bội ứng theo công thức:mdd = khối lượng các hóa học tan bỏ vào dung dịch + cân nặng dung môi – cân nặng chất kết tủa – cân nặng chất khí
Bước 3: Tìm khối lượng chất tan cần xác đinhBước 4: Tính C% theo phương pháp tính nồng độ phần trămChỉ cần thực hiện theo đúng 4 cách trên là bạn cũng có thể tính được nồng độ tỷ lệ của hóa học tan rồi. Để nhớ được công thức chúng ta cùng đi vào một trong những ví dụ cụ thể nhé!

Cách thực hiện công thức tính nồng độ xác suất cho từng chất
5. Một số chú ý khi tính nồng độ phần trăm của dung dịch
Một số điều cần chú ý để rất có thể tính được nồng độ tỷ lệ của dung dịch một cách đúng chuẩn nhất:
- Đọc kỹ thông tin, xác định chuẩn những nguyên tố đã cho và thành phần bắt buộc tính toán.
- Nhớ đúng mực các bí quyết để áp dụng cho phù hợp, né nhớ lầm lẫn mà áp dụng sai.
- Khi đo lường và tính toán cần thật cẩn thận, khám nghiệm kỹ để đưa ra công dụng đúng nhất.

Một số để ý cần nhớ lúc tính nồng độ phần trăm cho dung dịch
6. Mối quan hệ giữa nồng độ xác suất và những nồng độ hỗn hợp khác
Công thức contact giữa mật độ mol( CM) và nồng độ tỷ lệ (C%) của hóa học tan gồm phân tử khối M là:
CM=10.D.C%/M
7. Mật độ mol là gì? bí quyết tính mật độ mol
7.1. Tư tưởng nồng độ mol và cách làm tính
Sau khi biết được mối quan hệ giữa nồng độ phần trăm với nồng độ mol, chắc rằng nhiều các bạn sẽ thắc mắc về khái niệm nồng độ mol là gì? và đây chính là câu trả lời.
Nồng độ mol là đại lượng cho thấy thêm mối liên hệ giữa số mol của một hóa học tan với thể tích của dung dịch. Phương pháp tính nồng độ có thể được ban đầu từ số mol với thể tích, khối lượng và thể tích, hoặc số mol và mililit (ml). Công thức tính độ đậm đặc mol xác minh như sau:
Công thức tính nồng độ Mol: CM=n/V. Chú ý: đề nghị đổi đơn vị thể tích ml sang trọng lít.
Xác định độ đậm đặc mol của hỗn hợp với số mol và thể tíchNồng độ mol diễn đạt mối contact giữa số mol của một chất tan phân tách cho thể tích của dung dịch, tính bằng lit. Rõ ràng như sau:
Nồng độ mol = số mol hóa học tan / số lít dung dịch
Xác định nồng độ mol của hỗn hợp từ trọng lượng và thể tíchNồng độ mol thể hiện mối liên hệ giữa số mol của một chất tan cùng với thể tích dung dịch. Rõ ràng như sau:
Nồng độ mol = nồng độ hóa học tan / số lít dung dịch
Xác định độ đậm đặc mol của dung dịch từ số mol cùng ml dung dịchVới phương pháp tính độ đậm đặc mol này, bạn cần phải xác định số mol của hóa học tan trong một (l) hỗn hợp thay vày (ml) dung dịch. Nỗ lực thể, công thức tính C mol như sau:
Nồng độ mol = số mol chất tan / số lít dung dịch
7.2. Một số bài toán tính nồng độ mol
Bài tập 1: Tính độ đậm đặc mol của dung dịch có chứa 0,75 mol Natri Clorua trong 4,2l dung dịch?Lời giải:
Ta tất cả số mol chất tan là 0,75 mol cùng thể tích dung dịch là 4,2l. Trường đoản cú đó, khẳng định được mật độ mol của dung dịch là:
CM = 0,75 / 4,2 = 0,179 (mol/l)
Bài tập 2: Tính mật độ mol của dung dịch khi kết hợp 3,4 g KMnO4 trong 5,2l nước.
Lời giải:
Ta tất cả số mol hóa học tan KMn
O4 = số gam chất tan / phân tử khối của hóa học tan = 3,4 / 158 = 0,0215 mol. Từ bỏ đó, xác minh được độ đậm đặc mol của dung dịch là:
CM = 0,0215 / 5,2 = 0,004 (mol/l)
Bài tập 3: Tính nồng độ mol của một dung dịch cất 1,2 mol canxi Clorua trong 2905ml nước.Lời giải:
Ta tất cả 2905ml = 2,905l. Nồng độ mol của dung dịch vẫn là:
CM = 1,2 / 2,905 =0,413 mol/l
Như vậy nhằm tính nồng độ mol của dung dịch, bạn cần xác định đúng đắn về số mol hóa học tan có trong dung dịch, cũng giống như thể tích của hỗn hợp đó.
8. Bài xích tập áp dụng tính độ đậm đặc phần trăm
Bài tập 1: hài hòa hết 20 gam NaCl vào trong 40 gam nước. Hãy tính nồng độ xác suất của dung dịch này.
Lời giải:
Ta có khối lượng dung dịch là: mdd = mct + mdm = 20 + 40 = 60 gam
Vậy nồng độ phần trăm dung dịch là: C%= x 100% = x 100%= 33,3 %.
Kết luận: Vậy nồng độ hỗn hợp của Na
Cl là 33,3%.
Lời giải:
Ta có trọng lượng dung dịch là: mdd = mct + mdm = 10 + 40 = 50 gam
Vậy nồng độ phần trăm dung dịch là: C%= x 100% = x 100%= trăng tròn %.
Kết luận: Vậy nồng độ hỗn hợp của con đường là 20%
Bài tập 3: tổng hợp CCO3 vào 200g hỗn hợp HCl 7,3% (vừa đủ), hãy tính nồng độ xác suất của những chất bao gồm trong hỗn hợp sau phản ứng.Lời giải:
Khối lượng của HCL tất cả trong 200g hỗn hợp HCL 7,3% là:
m
HCl = (C% x mdd)/100% = 200 x 7,3/100 = 14,6 (gam)
=> n
HCl = 0,4mol
Ta tất cả phương trình: Ca
CO3 + 2HCl -> Ca
Cl2 + H2O + CO2
n
Ca
CO3= n
Ca
Cl2 = n
CO2 = ½ n
HCl = 0,2 mol -> m
Ca
CO3 = 20 (gam)
m
Ca
Cl2 = 0,2 x111 = 22,2 (gam)
m
CO2 = 0,2 x 44 = 8,8 (gam)
m dd sau làm phản ứng = m
Ca
CO3 + mdd HCl - m
CO2 = 20 + 200 - 8,8 = 211,2 (gam)
Nồng độ của Ca
Cl2 là:
C% dd Ca
Cl2 = (22,3 x 100%)/ (211 x2) = 10,51%
OH 20% tính năng vừa đầy đủ với 200 gam dung dịch HCl hiện ra Na
Cl với H2O. Hãy tính nồng độ muối hiện ra sau bội phản ứng.
Lời giải:
Khối lượng Na
OH là:
m
Na
OH = mdd x C%/100 = 400 x 20/100 = 80 (gam)
=> n
Na
OH = 80/40 = 3 (mol)
Ta gồm phương trình làm phản ứng: Na
OH + HCl -> Na
Cl + H2O
Theo phương trình hóa học: 1 mol -> 1 mol -> 1 mol
Muối thu được sau phản nghịch ứng là Na
Cl
m
Na
Cl = 2 x 5,5 = 117 gam
Phản ứng không xuất hiện kết tủa hay chất khí nên khối lượng dung dịch sau phản bội ứng là:
mdd sau làm phản ứng = mdd Na
OH + mdd HCl = 400 + 200 = 600 (gam)
=> C% dd
Na
Cl = 117/600 x 100% = 19,5 %
Lời giải:
Ta bao gồm phương trình bội nghịch ứng chất hóa học sau:
2K + 2H2O —–> 2KOH + H2
Số mol của K = 3,9/ 39 = 0,1 => mol KOH = 0,1 => mol H2O = 0,05
Sau khi cân đối phương trình chất hóa học ta được phương trình sau:
mdd = mk + m
H2O – m
H2 = 3,9 + 36,2 – (0,05.2) = 40 gam
→ Áp dụng bí quyết C% = (mct/mdd).100% ta tất cả C% = <(0,1.56)/40>.100% = 14%
=> Nồng độ hỗn hợp của B là 15%
Kết luận: Khi tiến hành hòa chảy 3,9 gam Kali vào 36,2 gam nước vẫn thu được dung dịch gồm nồng độ 14%.
Quá dễ dàng phải không những bạn, tuy vậy để học xuất sắc môn chất hóa học thì đòi hỏi họ phải siêng chỉ, đầu tư và khoa học. Liên tiếp ôn tập những dạng bài xích tập, thế chắc lý thuyết, công thức, tính đến cách làm để tìm kiếm ra bí quyết làm đúng đắn và công dụng nhất.
Xem thêm: Học Tiếng Anh Qua Skype Với Giáo Viên Nước Ngoài Tốt Hơn, Học Tiếng Anh Qua Skype Với Giáo Viên Nước Ngoài
Hy vọng, với phần đông thông tin share vừa rồi về công thức tính nồng độ phần trăm đang giúp chúng ta học sinh hoàn toàn có thể nắm vững được công thức và giải được các bài tập tương quan đến tính nồng độ phần trăm một cách xuất nhan sắc nhất. Chúc chúng ta may mắn.