
. Viết PTHHMột số tín hiệu để phân biệt các chất
Dạng 2: loại chỉ được sử dụng thuốc demo duy nhấtTa dung thuốc thử độc nhất ấy để tìm ra một lọ. Lọ tìm được này chính là thuốc thử cho những lọ còn lại*Chú ý:.Nếu những chất nên tìm chứa các gốc CO3, SO3, S ta nên dùng HCl hoặc H2SO4 làm thuốc thử. Nếu các chất phải tìm đựng dd các kim loại Fe, Mg, Zn, Al…ta buộc phải dùng dd kiềm làm cho thuốc thử
Dạng 3: Không sử dụng thêm dung dịch thử như thế nào khác. Trích chủng loại thử. Rước một mẫu thử thứu tự cho chức năng với các mẫu thử còn lại. Kẻ bảng. Nhờ vào bảng để kết luận
Bài 1: có 8 hỗn hợp trong xuyên suốt sau đây: Ba
Cl2, Na
Cl, Na2CO3, Ba(OH)2, HCl, H2SO4, Mg
SO4, Mg(NO3)2, chứa trong 8 bình đơn lẻ bị mất nhãn. Chỉ được chọn sử dụng thêm một thuốc demo hãy nhận ra mỗi dd bên trên bằng phương thức hóa học

Cl, Na2CO3, Ca
CO3, Ba
SO4Nếu được hãy trình bày cách nhận thấy và viết những PTHH

Cl2 cùng dd H2SO4 loãng, những ống nghiệm, phễu, giấy lọc, ống hút. Hãy phân biệt các dd tất cả hổn hợp sau: Na
HCO3 và K2CO3; KHCO3 cùng Na2SO4; Na2CO3 và K2SO4

HCl, Na2CO3, Ca(NO3)2

Cl2, K2SO4, Na3PO4Hãy xác minh số sản phẩm công nghệ tự các dd trên nếu biết. Dd 1 sinh sản kết tủa white với dd 3. Dd 2 sản xuất kết tủa trắng với cùng với dd 3 cùng dd 4. Dd 3 tạo nên kết tủa white với dd 5. Kết tủa tạo ra từ dd 2 cùng dd 3 dễ dẫn đến phân hủy cho oxit kim loại
Lớp 1
Tài liệu Giáo viên
Lớp 2Lớp 2 - kết nối tri thức
Lớp 2 - Chân trời sáng tạo
Lớp 2 - Cánh diều
Tài liệu Giáo viên
Lớp 3Lớp 3 - liên kết tri thức
Lớp 3 - Chân trời sáng sủa tạo
Lớp 3 - Cánh diều
Tài liệu Giáo viên
Lớp 4Sách giáo khoa
Sách/Vở bài xích tập
Tài liệu Giáo viên
Lớp 5Sách giáo khoa
Sách/Vở bài xích tập
Tài liệu Giáo viên
Lớp 6Lớp 6 - kết nối tri thức
Lớp 6 - Chân trời sáng tạo
Lớp 6 - Cánh diều
Sách/Vở bài bác tập
Tài liệu Giáo viên
Lớp 7Lớp 7 - kết nối tri thức
Lớp 7 - Chân trời sáng tạo
Lớp 7 - Cánh diều
Sách/Vở bài xích tập
Tài liệu Giáo viên
Lớp 8Sách giáo khoa
Sách/Vở bài bác tập
Tài liệu Giáo viên
Lớp 9Sách giáo khoa
Sách/Vở bài bác tập
Tài liệu Giáo viên
Lớp 10Lớp 10 - liên kết tri thức
Lớp 10 - Chân trời sáng sủa tạo
Lớp 10 - Cánh diều
Sách/Vở bài tập
Tài liệu Giáo viên
Lớp 11Sách giáo khoa
Sách/Vở bài tập
Tài liệu Giáo viên
Lớp 12Sách giáo khoa
Sách/Vở bài bác tập
Tài liệu Giáo viên
thầy giáoLớp 1
Lớp 2
Lớp 3
Lớp 4
Lớp 5
Lớp 6
Lớp 7
Lớp 8
Lớp 9
Lớp 10
Lớp 11
Lớp 12

Các dạng bài bác tập hóa học lớp 9Chương 1: những loại hợp hóa học vô cơ
Chương 2: Kim loại
Chương 3: Phi kim. Qua loa về bảng tuần hoàn những nguyên tố hóa học
Chương 4: Hiđrocacbon. Nhiên liệu
Chương 5: Dẫn xuất của Hiđrocacbon. Polime
Bài tập nhận biết và phân biệt các chất vô sinh và cách giải
Với bài xích tập nhận thấy và phân biệt các chất vô sinh và biện pháp giải môn hóa học lớp 9 sẽ giúp đỡ học sinh nắm rõ lý thuyết, biết phương pháp giải các dạng bài bác tập từ đó bài bản ôn tập kết quả để đạt kết quả cao trong số bài thi môn chất hóa học 9.
Bạn đang xem: Dạng bài tập nhận biết hóa 9

I. Kim chỉ nan và phương pháp giải
- Dựa vào tính chất hoá học và các dấu hiệu nhận thấy các hợp hóa học vô cơ (kết tủa, khí, thay đổi màu dung dịch…) đã có được học để tiến hành nhận biết các hợp chất vô cơ.
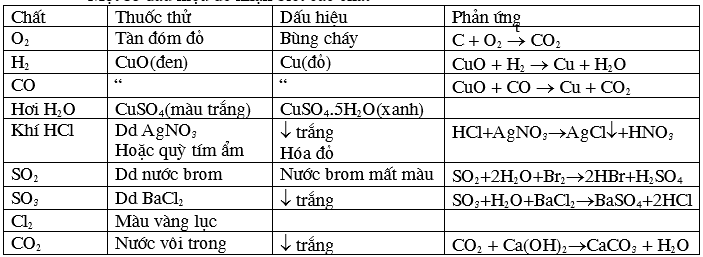
Dưới đấy là một số tín hiệu để nhận ra các chất thường gặp:
Hoá chất | Thuốc thử | Hiện tượng | Phương trình minh hoạ | |
- Axit -Dd bazơ | Quỳ tím | - Quỳ tím hoá đỏ - Quỳ tím hoá xanh | ||
Gốc sunfat (SO4) | - Ba -Ba(OH)2 | Tạo kết tủa trắng không tan vào axit mạnh | H2SO4 + Ba Na2SO4+Ba(OH)2→Ba | |
Gốc sunfit (SO3) | - Ba - Axit | - tạo thành kết tủa trắng. - tạo nên khí ko màu, mùi hương hắc. | Na2SO3 + Ba Na2SO3 + 2HCl→Ba | |
Gốc cacbonat (CO3) | - Axit - Ba | -Tạo khí không màu. -Tạo kết tủa trắng. | Ca Na2CO3 + Ba | |
Gốc clorua (Cl) | Ag | Tạo kết tủa trắng | HCl + Ag Na | |
Muối sunfua (S) | Pb(NO3)2 | Tạo kết tủa đen. | Na2S + Pb(NO3)2 →Pb | |
Muối fe (II) | Dung dịch kiềm (Na | Tạo kết tủa white xanh, kế tiếp bị hoá nâu kế bên không khí. | Fe 4Fe(OH)2 + O2 + 2H2O →4Fe(OH)3↓ | |
Muối fe (III) | Tạo kết tủa màu nâu đỏ | Fe | ||
Muối magie | Tạo kết tủa trắng | Mg | ||
Muối đồng | Tạo kết tủa xanh lam | Cu(NO3)2 + 2Na | ||
Muối nhôm | Tạo kết tủa trắng, rã trong kiềm dư | Al Al(OH)3 + Na | ||
Một số khí tốt gặp:
KHÍ | THUỐC THỬ | HIỆN TƯỢNG | PHƯƠNG TRÌNH HÓA HỌC MINH HỌA | |
1 | SO2 | - dd Br2 - dd KMn | - Mất gray clolor đỏ - Mất color tím | SO2 + Br2 + 2H2O → 2HBr + H2SO4 5SO2+2KMn |
2 | CO2 | Ca(OH)2 dư/Ba(OH)2 dư | trắng | CO2 + Ca(OH)2 → Ca CO2 + Ba(OH)2 → Ba |
3 | CO | Cu | Cu | Cu 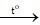 CO2 + Ca(OH)2 → Ca |
4 | Cl2 | - quỳ tím ẩm - dd KI, hồ tinh bột. | - Quỳ tím độ ẩm chuyển đỏ kế tiếp mất màu - có tác dụng xanh hồ tinh bột | -Cl2 + H2O ⇄ HCl + HCl Lúc đầu quỳ tím đưa đỏ sau đó hối hả mất màu do chức năng tẩy màu của HCl -Cl2 + 2KI → 2KCl + I2 I2 xuất hiện làm xanh hồ nước tinh bột. |
5 | H2 | Cu | Cu | Cu  |
6 | O2 | Que đóm còn tàn đỏ | Que đóm bùng cháy | C + O2 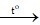 |
- Để giải một bài bác tập phân biệt/ nhận ra các chất vô cơ ta thường tiến hành theo các bước sau:
+ bước 1: Trích mẫu thử (có thể tấn công số các ống nghiệm để tiện theo dõi).
+ bước 2: lựa chọn thuốc test để nhận ra (tuỳ theo yêu mong của đề bài: thuốc demo tuỳ chọn, hạn chế hay là không dùng thuốc thử như thế nào khác).
+ bước 3: cho thuốc demo vào mẫu, trình bày hiện tượng quan lại sát, rút ra kết luận đã nhận được ra hoá chất nào.
+ bước 4: Viết phương trình bội nghịch ứng minh hoạ.
II. Ví dụ minh họa
Ví dụ 1: Có tía chất rắn white color đựng trong 3 lọ riêng biệt không nhãn là: Na2CO3, Na
Cl, tất cả hổn hợp Na
Cl với Na2CO3.
- Hãy nhận thấy chất đựng trong mỗi lọ bằng phương pháp hoá học.
- trình diễn cách triển khai và viết phương trình hoá học.
Lời giải:
- lấy mỗi chất một lượng nhỏ ra ống nghiệm và đánh số đồ vật tự.
- nhỏ dung dịch Ba(NO3)2 theo lần lượt vào 3 ống nghiệm.
⇒Ống nghiệm nào xuất hiện thêm kết tủa chứng tỏ ống nghiệm đó chứa Na2CO3 hoặc các thành phần hỗn hợp Na
Cl và Na2CO3, ống nghiệm sót lại chứa Na
Cl.
- Tiếp tục nhỏ tiếp hỗn hợp Ag
NO3 vào ống nghiệm có kết tủa.
⇒Ống nghiệm nào xuất hiện thêm thêm kết tủa minh chứng ống nghiệm kia chứa các thành phần hỗn hợp Na
Cl và Na2CO3, ống còn sót lại chứa Na2CO3
⇒Chúng ta đã nhận biết được các chất bị mất nhãn
Phương trình phản nghịch ứng hóa học xảy ra:
Ba(NO3)2 + Na2CO3 → Ba
CO3↓ + 2Na
NO3
Na
Cl + Ag
NO3 → Ag
Cl↓ + Na
NO3
Ví dụ 2: bao gồm một lượng bột Fe2O3 bị lẫn một lượng bột Al. Nêu bí quyết tinh chế bột Fe2O3 trên.
Lời giải:
Cho hỗn hợp vào lượng dư dung dịch Na
OH.
Al làm phản ứng cùng với Na
OH sinh sản thành dung dịch, Fe2O3 không phản ứng với Na
OH.
2Al + 2H2O + 2Na
OH → 2Na
Al
O2 + 3H2
Kết thúc làm phản ứng, mang lọc nhận được Fe2O3 tinh khiết.
III. Bài bác tập trường đoản cú luyện
Bài 1 Thuốc thử dùng để làm nhận biết hỗn hợp HCl cùng dung dịch H2SO4 là:
A. K2SO4
B. Ba(OH)2
C. Na
Cl
D. Na
NO3
Bài 2: Để nhận thấy 2 lọ mất nhãn đựng Ca
O cùng Mg
O ta dùng:
A. HCl
B. H2O
C. HNO3
D. Quỳ tím khô.
Xem thêm: Lời Xin Lỗi Của Một Dân Chơi, Lyrics: *Loi Xin Loi Cua Mot… Cs** Duy Manh
Bài 3: Để nhận ra 3 khí ko màu: SO2, O2, H2 đựng vào 3 lọ mất nhãn ta dùng:
A. Giấy quỳ tím ẩm
B. Giấy quỳ tím ẩm và cần sử dụng que đóm cháy dở còn tàn đỏ
C. Than hồng trên que đóm
D. Dẫn những khí vào nước vôi trong
Bài 4: Để loại trừ khí CO2 bao gồm lẫn trong hỗn hợp (O2, CO2), người ta mang đến hỗn hợp trải qua dung dịch chứa:
A. HCl
B. Ca(OH)2
C. Na2SO4
D. Na
Cl
Bài 5: tất cả 3 ống thử đựng những dung dịch: Ba(NO3)2, KOH, HCl. Dùng thêm thuốc thử nào dưới đây để phân biệt được bọn chúng ?
A. Quỳ tím
B. Dung dịch phenolphtalein
C. CO2
D. Hỗn hợp Na
OH
Bài 6: gồm 3 lọ mất nhãn đựng đơn nhất 3 dung dịch của 3 chất: HCl, Na2SO4, Na
OH. Chỉ dùng một hóa chất nào sau đây để sáng tỏ chúng?
A. Hỗn hợp Ba
Cl2
B. Quỳ tím
C. Hỗn hợp Ba(OH)2
D. Zn
Bài 7: Thuốc demo để nhận thấy ba lọ mất nhãn chứa hiếm hoi 3 dung dịch: H2SO4, Ba
Cl2, Na
Cl là:
A. Phenolphtalein.
B. Dung dịch Na
OH.
C. Dung dịch Na2CO3.
D. Dung dịch Na2SO4.
Bài 8: sau khi làm thí nghiệm, gồm có khí giả độc hại: HCl, H2S, CO2, SO2. Cần sử dụng chất nào sau đây để loại trừ chúng là tốt nhất?
A. Muối Na
Cl
B. Nước vôi vào
C. Dung dịch HCl
D. Dung dịch Na
NO3
Bài 9: Để có tác dụng sạch dung dịch đồng nitrat Cu(NO3)2 bao gồm lẫn tạp chất bạc tình nitrat Ag
NO3. Ta sử dụng kim loại:
A. Mg
B. Cu
C. Fe
D. Au
Bài 10: Để nhận biết 3 lọ mất nhãn đựng 3 hỗn hợp Cu
Cl2, Fe
Cl3, Mg
Cl2 ta dùng: