Hóa học tập 11 bài xích 22: cấu tạo phân tử hợp hóa học hữu cơ được trung học phổ thông Lê Hồng Phong biên soạn mong muốn sẽ tà tà tài liệu bổ ích giúp các em nắm rõ kiến thức bài học và đạt kết quả tốt trong các bài thi, bài xích kiểm tra trên lớp.
Bạn đang xem: Mục lục sách giáo khoa (sgk) hóa 11
Tóm tắt triết lý Hóa học 11 bài 22
I. Phương pháp cấu tạo
1. Khái niệm
– Công thức kết cấu biểu diễn thiết bị tự và phương thức liên kết (liên kết đơn, links bội) của những nguyên tử vào phân tử.
2. Những loại công thức cấu tạo
a) Công thức cấu trúc khai triển
– biểu diễn trên mặt phẳng giấy tất cả các liên kết.
– Thí dụ: Công thức cấu trúc khai triển của rượu etylic (C2H5OH).

b) Công thức kết cấu thu gọn
– những nguyên tử, nhóm nguyên tử cùng liên kết với một nguyên tử cacbon được viết thành một nhóm.
Thí dụ: CH3 – CH2 – OH, CH2 = CH – CH = CH2,…
– Hoặc chỉ biểu diễn liên kết giữa những nguyên tử cacbon và với team chức.
+ từng đầu một đoạn thẳng hoặc điểm cấp khúc ứng với cùng 1 nguyên tử cacbon.
+ Không thể hiện số nguyên tử hiđro link với mỗi nguyên tử cacbon.
– Thí dụ:

Hình 1: một vài thí dụ đổi khác công thức kết cấu đầy đầy đủ sang công thức thu gọn
II. Thuyết cấu trúc hóa học
1. Nội dung
– vào phân tử hợp chất hữu cơ, các nguyên tử links với nhau theo đúng hóa trị và theo một thứ tự độc nhất vô nhị định. Vật dụng tự link đó gọi là cấu trúc hóa học.
⇒ Sự biến hóa thứ tự link đó, tức là đổi khác cấu tạo thành hóa học, sẽ khởi tạo ra hợp hóa học khác.
Thí dụ: phương pháp phân tử C2H6O gồm hai công thức cấu trúc ứng cùng với 2 hợp chất sau:
H3C−O−CH3: đimetyl ete, chất khí, không tính năng với Na.
H3C−CH2−OH: ancol etylic, chất lỏng, công dụng với Na hóa giải hiđro.
– vào phân tử hợp chất hữu cơ, cacbon tất cả hóa trị 4. Nguyên tử cacbon không những hoàn toàn có thể liên kết cùng với nguyên tử những nguyên tố khác nhưng còn liên kết với nhau thành mạch cacbon.
Thí dụ:

– Tính chất của những chất dựa vào vào thành phần phân tử (bản chất, số lượng các nguyên tử) và cấu trúc hóa học (thứ trường đoản cú liên kết những nguyên tử).
Thí dụ:
+ dựa vào thành phần phân tử: CH4 là hóa học khí dễ dàng cháy, CCl4 là hóa học lỏng ko cháy; CH3Cl là chất khí ko có công dụng gây mê, còn CHCl3 là chất lỏng có tính năng gây mê.
+ Phụ thuộc kết cấu hóa học: CH3CH2OH và CH3OCH3 khác nhau cả về tính chất hóa học.
2. Ý nghĩa
– Thuyết kết cấu hóa học tập giúp phân tích và lý giải được hiện tượng đồng đẳng, hiện tượng kỳ lạ đồng phân.
II. Đồng đẳng đồng phân
1. Đồng đẳng
– Đồng đẳng là hiện nay tượng các chất hữu cơ có cấu tạo và đặc điểm hóa học tựa như nhau nhưng lại thành phần phân tử hơn kém nhau một hay những nhóm CH2.
– các chất thuộc cùng dãy đồng đẳng vừa lòng thành một hàng đồng đẳng gồm công thức chung.
Thí dụ: dãy đồng đẳng của metan: CH4, CH3 – CH3, CH3 – CH2 – CH3,…
⇒ bí quyết chung là Cn
H2n + 2.
2. Đồng phân
– Đồng phân là các chất hữu cơ gồm cùng cách làm phân tử nhưng cấu trúc khác nhau nên đặc điểm hóa học tập khác nhau.
– gồm hai các loại đồng phân chính:
+ Đồng phân cấu trúc gồm: đồng phân mạch cacbon, đồng phân loại nhóm chức, đồng phân vị trí link bội hoặc đội chức,…
+ Đồng phân lập thể: đồng phân không giống nhau về vị trí không gian của những nhóm nguyên tử.

Hình 2: Đồng phân lập thể của CHCl = CHCl
III. Liên kết hóa học cùng cấu trúc phân tử hợp chất hữu cơ
– link thường gặp mặt trong hợp chất hữu cơ là liên kết cộng hóa trị, gồm links σ và links π.
– Sự tổng hợp của liên kết σ cùng π sản xuất thành liên kết đôi hoặc ba (liên kết bội).
1. Links đơn (σ)
Bạn đã xem: chất hóa học 11 bài 22: cấu trúc phân tử hợp hóa học hữu cơ – Giải bài tập SGK hóa học 11 bài xích 22
– do 1 cặp electron tầm thường tạo thành, được trình diễn bằng 1 gạch men nối giữa 2 nguyên tử.
– links σ bền.

Hình 3: quy mô phân tử metan dạng trống rỗng a) với dạng đặc b).
2. Links đôi (1 σ cùng 1 π)
– do 2 cặp electron thông thường tạo thành, được trình diễn bằng 2 gạch nối song song giữa 2 nguyên tử.
– gồm 1σ bền với 1 π nhát bền.

Hình 4: quy mô phân tử etilen dạng trống rỗng A với dạng sệt B
3. Liên kết ba (1 σ cùng 2 π)
– bởi 3 cặp electron chung tạo thành, được màn trình diễn bằng 3 gạch nối tuy nhiên song thân 2 nguyên tử.
– gồm 1σ bền và 2 π kém bền.

Hình 5: quy mô phân tử axetilen dạng trống rỗng A với dạng đặc B
Giải bài xích tập SGK chất hóa học 11 bài bác 22
Bài 1 (trang 101 SGK Hóa 11)
Phát biểu ngôn từ cơ bản của thuyết cấu tạo hoá học.
Lời giải:
– vào phân tử hợp hóa học hữu cơ, những nguyên tử links với nhau theo như đúng hóa trị với theo một sản phẩm công nghệ tự duy nhất định. Sản phẩm công nghệ tự link đó call là kết cấu hóa học. Sự chuyển đổi thứ tự liên kết đó, tức là biến hóa cấu chế tác hóa học, sẽ tạo nên ra hợp hóa học khác.
– vào phân tử hợp chất hữu cơ, cacbon bao gồm hóa trị bốn. Nguyên tử cacbon không những rất có thể liên kế với nguyên tử của các nguyên tố khác nhưng mà còn liên kết với nhau sản xuất thành mạch cacbon (mạch vòng, mạch không vòng, mạch nhánh, mạch ko nhánh).
– Tính chất của những chát phụ thuộc vào yếu tố phân tử (bản chất, số lượng các nguyên tử) và cấu trúc hó học tập (thứ từ liên kết những nguyên tử).
Bài 2 (trang 101 SGK Hóa 11)
So sánh chân thành và ý nghĩa của bí quyết phân tử và công thức cấu tạo. Mang đến thí dụ minh hoạ?
Lời giải:
– Giống nhau: Cho biết số lượng mỗi thành phần trong phân tử.
– Khác nhau:
| Công thức phân tử | Công thức cấu tạo |
| – tương tự nhau: Cho biết con số mỗi nhân tố trong phân tử – không giống nhau: Chưa biết được tính chất của các hợp hóa học hữu cơ. – Thí dụ: CTPT C3H6 ta chưa biết hợp chất này là gì. Chỉ biết hợp chất tất cả 3 nguyên tử C với 6 nguyên tử H | – cho biết thêm số lượng mỗi nguyên tố vào phân tử. – cho thấy thứ từ liên kết của các nguyên tử trong phân tử và từ kia biết được xem chất của những hợp chất hữu cơ. – CTPT C3H6 – nếu như CTPT CH2=CH-CH3 Là anken có phản ứng đặc trưng là bội phản ứng cộng – trường hợp CTCT là 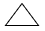 |
Bài 3 (trang 101 SGK Hóa 11)
Thế như thế nào là links đơn, links đôi, links ba?Lời giải:
Liên kết đơn: (còn call là link σ) được tạo vị một cặp e cần sử dụng chung
Thí dụ: H:H
CTCT H-H
Liên kết đôi: tạo vày 2 cặp e dùng chung. Trong các số ấy có một links σ chắc chắn và một liên kết π linh động, dễ dẫn đến đứt ra khi gia nhập phản ứng hoá học.
Thí dụ H2C :: CH2
CTCT H2C=CH2
Liên kết ba: được toạ bởi ba cặp dùng chung. Trong những số ấy có một links σ chắc chắn và hai link π linh động, dễ dẫn đến đứt ra khi tham gia phản ứng hoá học.
Thí dụ HC⋮⋮CH
CTCT: HC≡CH
Bài 4 (trang 101 SGK Hóa 11)
Chất nào dưới đây trong phân tử chỉ có links đơn?
A. CH4 ;
B. C2H4
C. C6H6 ;
D. CH3COOH
Lời giải:
– Đáp án A
– Chỉ bao gồm CH4 là vào phân tử chỉ có liên kết đơn. Với những chất còn lại thì vào phân tử bao gồm cả link đơn cùng đôi.
Bài 5 (trang 101 SGK Hóa 11)
Những chất nào sau đây là đồng đẳng của nhau, đồng phân của nhau?

Lời giải:
– những chất đồng đẳng của nhau là:
+ a; d;e (là những anken)
+ a; d;g
+ b;d;e
+ b; d; g
+ c; h cùng h; i (là các ankan)
– những chât đồng phân của nhau là:
+ a; b vì đều có CTPT C4H8
+ e; g vì đều có CTPT C5H10
+ c; i vì đều sở hữu CTPT C5H12
Bài 6 (trang 102 SGK Hóa 11)
Viết công thức cấu tạo có thể có của các chất tất cả công thức phân tử như sau: C2H6O, C3H6O, C4H10.
Lời giải:

Bài 7 (trang 102 SGK Hóa 11)
Những công thức cấu trúc nào bên dưới đây bộc lộ cùng một chất?

Lời giải:
(I); (III) cùng (IV) là và một chất. Đều tất cả công thức là CH3CH2OH. (II) cùng (V) là cùng một chất, đều phải sở hữu công thức là CH2Cl2
Bài 8 (trang 102 SGK Hóa 11)
Khi mang đến 5,30 gam hỗn hợp gồm etanol C2H5OH với propan-1-ol CH3CH2CH2OH chức năng với natri (dư) thu được 1,12 lít khí (đktc).
a. Viết phương trình hoá học của các phản ứng xảy ra.
b. Tính nhân tố phần trăm cân nặng của mỗi hóa học trong hỗn hợp.
Lời giải:

a) 2C2H5OH + 2Na → 2C2H5ONa + H2↑ (1)
2CH3-CH2-СН2-ОН + 2Na → 2CH3-CH2-СН2-ONa + H2↑ (2)
b) call số mol của etanol là x của propan-1-ol là y (mol)
Theo (1) và (2) ta gồm hệ phương trình:

Trắc nghiệm chất hóa học 11 bài bác 22 gồm đáp án
Bài 1: Số cách làm tạo mạch hoàn toàn có thể có ứng với công thức phân tử C5H10 là
A. 5
B. 5
C. 3
D. 4.
Lời giải
Đáp án: B

Bài 2: Số công thức cấu tạo có thể tất cả ứng với những công thức phân tử C3H7Cl là
A. 1
B. 2
C. 3
D. 4.
Lời giải
Đáp án: B

Bài 3: Số công thức kết cấu có thể gồm ứng với các công thức phân tử C4H9Cl là
A. 5
B. 2
C. 3
D. 4.
Lời giải
Đáp án: D
Bài 4:. Số công thức cấu tạo có thể tất cả ứng với những công thức phân tử C3H6Cl2 là
A. 5
B. 2
C. 3
D. 4.
Lời giải
Đáp án: D

Bài 5: Số công thức kết cấu có thể có ứng với các công thức phân tử C3H8O là
A. 1
B. 2
C. 3
D. 4.
Lời giải
Đáp án: C

Bài 6: Số công thức cấu tạo có thể có ứng với những công thức phân tử C4H10O là
A. 8
B. 6
C. 7
D. 5.
Lời giải
Đáp án: C
Bài 7: Trong số những chất : C3H8, C3H7Cl, C3H8O cùng C3H9N ; chất có nhiều đồng phân cấu trúc nhất là
A. C3H7Cl
B. C3H8 C.
C3H9N
D. C3H8O.
Lời giải
Đáp án: C
Bài 8: chất nào sau đây trong phân tử chỉ có liên kết có liên kết đơn?
A. C2H4
B. C2H2
C. C6H6
D. C2H6.
Lời giải
Đáp án: D
Bài 9: hóa học nào dưới đây trong phân tử có liên kết đôi?
A. C2H4
B. C2H2
C. C3H8
D. C2H5OH.
Lời giải
Đáp án: A
Bài 10: hóa học nào dưới đây có phân tử có link ba?
A. C2H4
B. C2H2
C. CH4
D. CH3OH.
Lời giải
Đáp án: B
Bài 11: Cặp hóa học nào sau đó là đồng phân của nhau?
A. C2H5OH, CH3OCH3
B. CH3OCH3, CH3CHO.
C. CH3OH, C2H5OH
D. CH3CH2Cl, CH3CH2OH
Lời giải
Đáp án: A
Bài 12: Cặp hóa học nào sau đấy là đồng đẳng của nhau ?
A. CH3OH, CH3OCH3
B. CH3OCH3, CH3CHO.
C. CH3OH, C2H5OH
D. CH3CH2OH, C3H6(OH)2.
Lời giải
Đáp án: C
Bài 13: Số công thức cấu trúc có thể bao gồm ứng với các công thức phân tử C4H10 là
A. 1
B. 2
C. 3
D. 4.
Lời giải
Đáp án: B

Bài 14: Số phương pháp tạo mạch hở rất có thể có ứng với phương pháp phân tử C4H8 là
A. 1
B. 2
C. 3
D. 4.
Lời giải
Đáp án: C

******************
Trên đó là nội dung bài học Hóa học tập 11 bài bác 22: kết cấu phân tử hợp chất hữu cơ do trung học phổ thông Lê Hồng Phong biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm rõ kiến thức về kết cấu phân tử hợp hóa học hữu cơ. Chúc những em học hành thật xuất sắc và luôn đạt điểm cao trong các bài thi bài bác kiểm tra bên trên lớp.
Sách Giáo Khoa hóa học Lớp 11 được bộ giáo dục và Đào Tạo soạn và phân phát hành. Sách bao gồm chín chương đầy đầy đủ công thức, lý thuyết, phương trình hóa học, chuyên đề chất hóa học …
CHƯƠNG 1: SỰ ĐIỆN LI
Bài 1. Sự điện liBài 2. Axit, bazơ cùng muối
Bài 3. Sự điện li của nước. P
H. Chất thông tư Axit – bazơ
Bài 4. Phản bội ứng thảo luận ion vào dung dịch những chất điện li
Bài 5. Luyện tập: Axit, bazơ với muối. Làm phản ứng hội đàm ion trong dung dịch các chất điện li
Bài 6. Bài thực hành 1: Tính axit-bazơ. Phản nghịch ứng thảo luận ion vào dung dịch những chất điện li
Đề bình chọn 15 phút – Chương I – hóa học 11Đề bình chọn 45 phút (1 tiết) – Chương I – chất hóa học 11
CHƯƠNG 2: NITƠ – PHOTPHO
Bài 7. NitơBài 8. Amoniac và muối amoni
Bài 9. Axit nitric và muối nitrat
Bài 10. Photpho
Bài 11. Axit photphoric và muối photphat
Bài 12. Phân bón hóa học
Bài 13. Luyện tập: đặc điểm của Nitơ, photpho và những hợp chất của chúng
Bài 14. Bài thực hành thực tế 2: đặc thù của một trong những hợp chất nitơ, photpho
Đề khám nghiệm 15 phút – Chương II – chất hóa học 11Đề bình chọn 45 phút (1 tiết) – Chương II – chất hóa học 11
CHƯƠNG 3: CACBON – SILIC
Bài 15. CacbonBài 16. Hợp chất của cacbon
Bài 17. Silic với hợp hóa học của silic
Bài 18. Công nghiệp silicat
Bài 19. Luyện tập: tính chất của cacbon, silic và các hợp hóa học của chúng
Đề khám nghiệm 15 phút – Chương III – hóa học 11Đề chất vấn 45 phút (1 tiết) – Chương III – chất hóa học 11
CHƯƠNG 4: ĐẠI CƯƠNG VỀ HÓA HỌC HỮU CƠ
Bài 20. Khởi đầu về hoá học hữu cơBài 21. Phương pháp phân tử hợp hóa học hữu cơ
Bài 22. Kết cấu phân tử hợp chất hữu cơ
Bài 23. Phản nghịch ứng hữu cơ
Bài 24. Luyện tập: Hợp hóa học hữu cơ, công thức phân tử và phương pháp cấu tạo
Đề kiểm soát 15 phút – Chương IV – hóa học 11Đề soát sổ 45 phút (1 tiết) – Chương IV – hóa học 11
CHƯƠNG 5: HIDROCACBON NO
Bài 25. AnkanBài 26. Xicloankan
Bài 27. Rèn luyện ankan cùng xicloankan
Bài 28. Bài thực hành số 3 : so với định tính nguyên tố. Điều chế và đặc điểm của metan
Đề khám nghiệm 15 phút – Chương V – hóa học 11Đề kiểm tra 45 phút (1 tiết) – Chương V – chất hóa học 11
CHƯƠNG 6: HIDROCACBON KHÔNG NO
Bài 29. AnkenBài 30. Ankađien
Bài 31. Luyện tập: Anken với Ankadien
Bài 32. Ankin
Bài 33. Luyện tập: Ankin
Bài 34. Bài thực hành 4 : Điều chế và tính chất của etilen với axetilen
Đề đánh giá 15 phút – Chương VI – chất hóa học 11Đề chất vấn 45 phút (1 tiết) – Chương VI – hóa học 11
CHƯƠNG 7: HIĐROCACBON THƠM, NGUỒN HIĐROCACBON THIÊN NHIÊN. HỆ THỐNG HÓA VỀ HIĐROCACBON
Bài 35. Benzen với đồng đẳng. Một vài hiđrocacbon thơm khácBài 36. Luyện tập: Hiđrocacbon thơm
Bài 37. Nguồn Hiđrocacbon thiên nhiên
Bài 38. Khối hệ thống hóa về hiđrocacbon
Đề bình chọn 15 phút – Chương VII – chất hóa học 11Đề kiểm tra 45 phút (1 tiết) – Chương VII – chất hóa học 11
CHƯƠNG 8: DẪN XUẤT HALOGEN – ANCOL – PHENOL
Bài 39. Dẫn xuất halogen của hiđrocacbonBài 40. Ancol
Bài 41. Phenol
Bài 42. Luyện tập: Dẫn xuất halogen, ancol cùng phenol
Bài 43. Bài thực hành 5: đặc thù của etanol, glixerol với phenol
Đề chất vấn 15 phút – Chương VIII – hóa học 11Đề kiểm soát 45 phút (1 tiết) – Chương VIII – chất hóa học 11
CHƯƠNG 9: ANĐEHIT – XETON – AXIT CACBOXYLIC
Bài 44. Anđehit – xetonBài 45. Axit cacboxylic
Bài 46. Luyện tập: Anđehit – xeton – axit cacboxylic
Bài 47. Bài thực hành thực tế 6: đặc thù của anđehit và axit cacboxylic
Đề kiểm soát 15 phút – Chương IX – hóa học 11Đề kiểm tra 45 phút (1 tiết) – Chương IX – hóa học 11





Mê sở hữu Sách là thư viện sách online có thể chấp nhận được người dùng tải sách miễn phí, tải sách hay, download sách miễn phí, download sách hay, đọc sách online. Shop chúng tôi có rất nhiều sách thuộc nhiều thể một số loại với những format Ebook phổ biến cho điện thoại cảm ứng thông minh và vật dụng tính. Chúng ta đọc hoàn toàn có thể xem online hoặc download về máy nhằm tiện theo dõi.
Xem thêm: Hướng Dẫn Sử Dụng Prezi Chi Tiết, Hướng Dẫn Làm Slide Trên Prezi
Sách Giáo Khoa Lớp 1
Sách Giáo Khoa Lớp 2
Sách Giáo Khoa Lớp 3
Sách Giáo Khoa Lớp 4
Sách Giáo Khoa Lớp 5
Sách Giáo Khoa Lớp 6
Sách Giáo Khoa Lớp 7
Sách Giáo Khoa Lớp 8
Sách Giáo Khoa Lớp 9
Sách Giáo Khoa Lớp 10
Sách Giáo Khoa Lớp 11
Sách Giáo Khoa Lớp 12
Mọi tin tức và hình ảnh trên website hồ hết được đọc trên Internet. Shop chúng tôi không mua hay chịu trách nhiệm bất kỳ thông tin nào trên web này. Trường hợp làm tác động đến cá nhân hay tổ chức triển khai nào, lúc được yêu cầu, cửa hàng chúng tôi sẽ cẩn thận và gỡ quăng quật ngay lập tức.