I. Tổng hợp lý thuyết hóa 12: Tổng vừa lòng phương pháp3. Cách thức sơ vật dụng dường chéo:




CHƯƠNG I. ESTE – LIPIT
A- MỘT SỐ VẤN ĐỀ LÍ THUYẾT CẦN NẮM VỮNG1. định nghĩa về dẫn xuất của axit cacboxylic– Dẫn xuất của axit cacboxylic là những sản phẩm tạo ra khi thay thế sửa chữa nhóm hiđroxyl –OH trong nhóm cacboxyl -COOH bởi nguyên tử hay nhóm nguyên tử khác: -COOH -> –COZ (với Z: OR’, NH2, OCOR, halogen, …)– Este là dẫn xuất của axit cacboxylic. Khi thay thế nhóm OH ở team cacboxyl của axitcacboxylic bởi nhóm OR’ thì được este.– Halogenua axit (quan trọng độc nhất là clorua axit RCOCl). Để tạo thành halogenua axit cóthể dùng những tác nhân như PCl5 (photpho pentaclorua), PCl3 (photpho triclorua), COCl2(photgen), SOCl2 (thionyl clorua), …
(1)
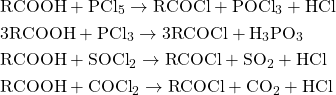
– Anhiđrit axit, gồm 2 loại: đối xứng (dạng (RCO)2O hoặc (Ar
CO)2O; điện thoại tư vấn tên bằng phương pháp thay tự axit bởi anhiđrit (CH3CO)2O là anhiđrit axetic), và không cân đối (sinh ra từ nhị axit monocacboxylic khác nhau như CH3CO-O-OCC6H5; gọi tên bởi từ anhiđrit cùng với thương hiệu của nhị axit – anhiđrit axetic benzoic)
Để sinh sản thành anhiđrit axit rất có thể sử dụng nhiều phương thức khác nhau như sử dụng tác nhân hút nước P2O5 hay chức năng của nhiệt, …
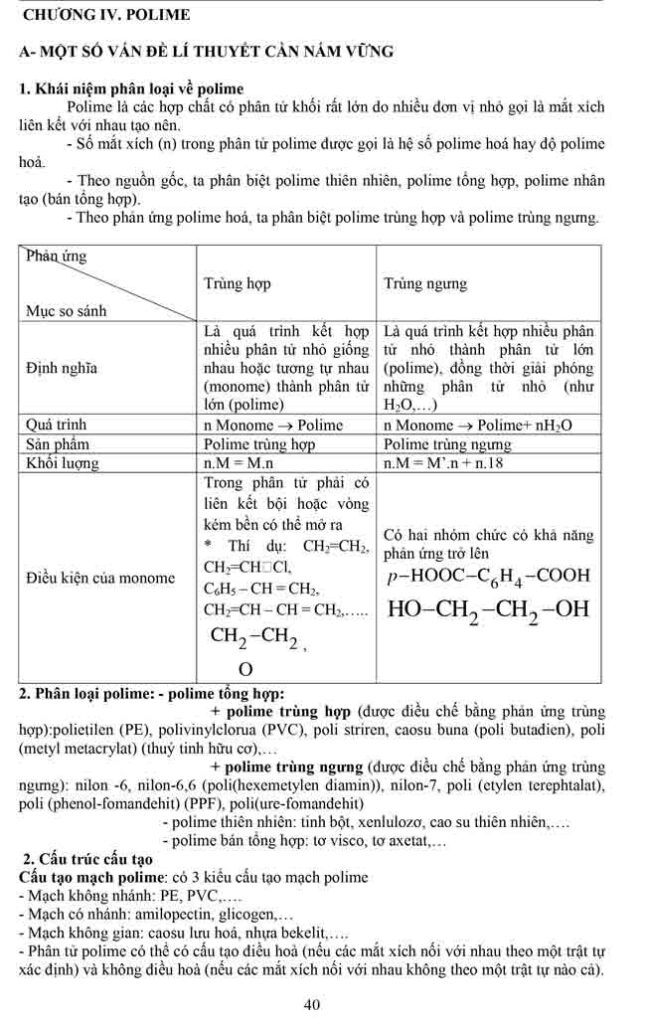
2. ESTE
2.1. Tư tưởng : Khi cầm nhóm OH ở team cacboxyl của axit cacboxylic bởi nhóm
OR thì được este* Công thức tổng quát của estea/ trường hợp solo giản: là este không đựng nhóm chức làm sao khác, ta có những công thứcnhư sau
-Tạo bởi vì axit cacboxylic đối kháng chức RCOOH với ancol đối kháng chức R’OH: RCOOR’.– Tạo do axit cacboxylic nhiều chức R(COOH)a và ancol solo chức R’OH: R(COOR’)a.– Tạo vày axit cacboxylic solo chức RCOOH và ancol đa chức R"(OH)b: (RCOO)b
R’.– Tạo bởi axit cacboxylic đa chức R(COOH)a và ancol đa chức R"(OH)b: Rb(COO)ab
R’a.Trong đó, R với R’ là gốc hiđrocacbon (no, không no hoặc thơm); ngôi trường hợp sệt biệt, Rcó thể là H (đó là este của axit fomic H-COOH).
Bạn đang xem: Tổng hợp công thức hóa học 12
b/Trường thích hợp phức tạp: là trường thích hợp este còn cất nhóm OH (hiđroxi este) hoặc estecòn cất nhóm COOH (este – axit) hoặc các este vòng nội phân tử … Este vào trườnghợp này sẽ cần xét ví dụ mà ko thể bao gồm CTTQ tầm thường được. Lấy một ví dụ với glixerol cùng axitaxetic hoàn toàn có thể có những hiđroxi este như HOC3H5(OOCCH3)2 hoặc (HO)2C3H5OOCCH3; hoặcvới axit oxalic với metanol hoàn toàn có thể có este – axit là HOOC-COOCH3.
c/ Công thức tổng thể dạng phân tử của este không cất nhóm chức khác

2.2.Lí tính :
– ánh nắng mặt trời sôi ,độ chảy trong nước thấp hơn axit và ancol gồm cùng số cacbon :axit > ancol > este-Một số mùi đặc thù : Isoamyl axetat : mùi chuối chín ; Etyl butiat ,etyl propionat cómùi dứa
2.3 TÍNH CHẤT HÓA HỌC :
1. Phản ứng thủy phânTính hóa học hoá học quan trọng nhất của este là phản nghịch ứng thuỷ phân. Sơ thiết bị thuỷ phâneste (về cơ bản, không xét những trường hợp đặc biệt) là :
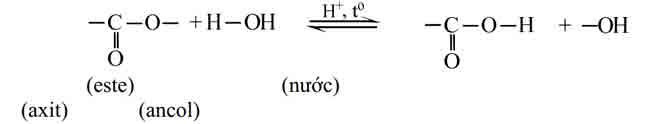
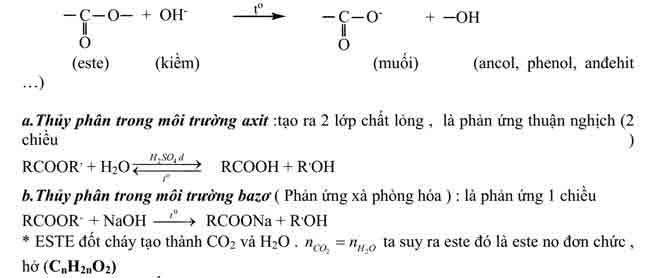
Thuỷ phân chính là quá trình nghịch của của bội nghịch ứng este hoá.Phản ứng thuỷ phân rất có thể xảy ra trong môi trường thiên nhiên axit hoặc môi trường xung quanh bazơ.– làm phản ứng thuỷ phân trong môi trường xung quanh kiềm được hotline là bội phản ứng xà chống hoá.Đặc điểm của phản bội ứng thuỷ phân este:– phản bội ứng thuỷ phân este trong môi trường axit là phản bội ứng thuận nghịch. Sản phẩm của phản bội ứng trong điều kiện này luôn có axit cacboxylic. Để chuyển dời cân bằng về phía chế tác axit và ancol, ta sử dụng lượng dư nước.– làm phản ứng thuỷ phân este không đều thuận nghịch mà còn rất chậm. Để tăng vận tốc phản ứng thuỷ phân ta đun nóng các thành phần hỗn hợp phản ứng cùng với với hóa học xúc tác axit (H2SO4, HCl…).
– phản nghịch ứng xà chống hoá chỉ xảy ra một chiều, sản phẩm thu được luôn có muối của axit cacboxylic.
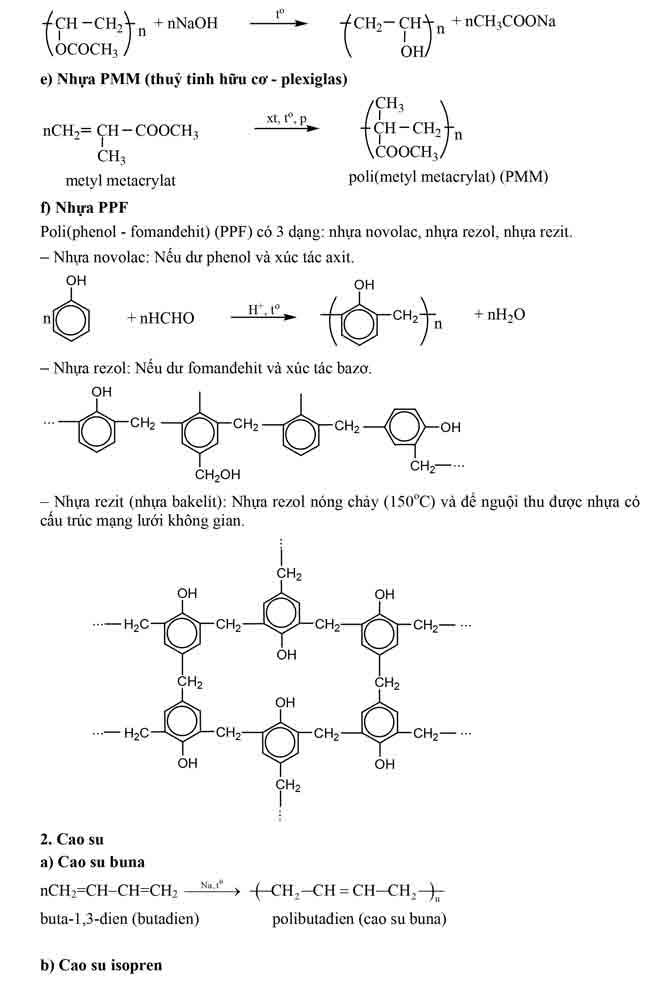
2/ phản nghịch ứng của gốc hiđrocacbonEste không no (este của axit ko no hoặc ancol ko no) có khả năng tham gia phản ứng cộng và phản ứng trùng vừa lòng – đây là tính chất do liên kết – nguyên lý (tương trường đoản cú như hiđrocacbon tương ứng). Một vài phản ứng trực thuộc loại này có ứng dụng quan trọng đặc biệt là :– phản ứng chuyển hoá dầu (chất béo lỏng) thành mỡ chảy xệ (chất to rắn)
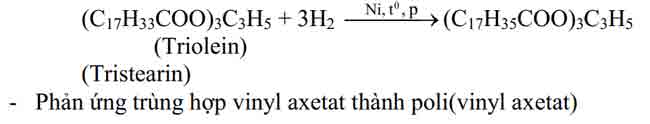

4. Một trong những phản ứng thuỷ phân quan trọng đặc biệt của esteCăn cứ vào sơ thiết bị phản ứng xà phòng hoá hay phản ứng thuỷ phân este ta có thể căn cứ vào sản phẩm tạo thành để suy đoán cấu sản xuất của este ban đầu.Không độc nhất vô nhị thiết sản phẩm ở đầu cuối phải gồm ancol, tuỳ ở trong vào việc nhóm –OH thêm vào cội hiđrocacbon có cấu tạo như thế nào mà sẽ sở hữu các làm phản ứng tiếp sau xảy ra để sở hữu sản phẩm sau cuối hoàn toàn khác nhau, hoặc nữa là do cấu tạo bất thường của este tạo nên.
Một số trường vừa lòng thuỷ phân đặc trưng của este (không chứa halogen) thường chạm chán trong vấn đề định lượng là :
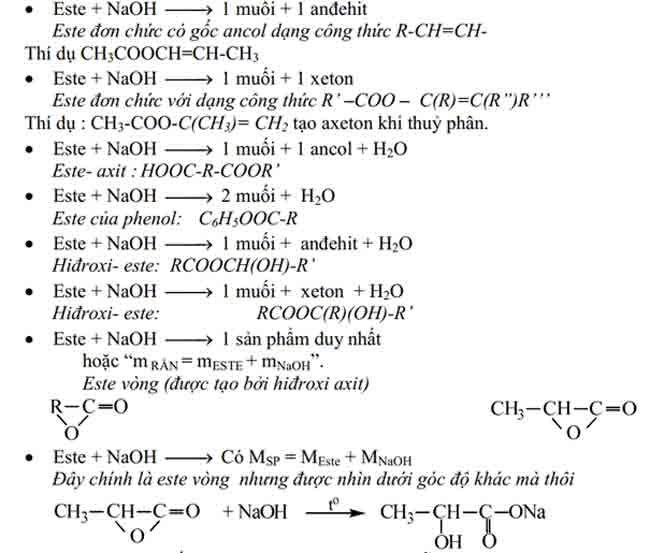
Chú ý các tóm lại in nghiêng ngay dưới mỗi trường vừa lòng trên đây chỉ là 1 thí dụ đơn giản và dễ dàng nhất, các em chỉ được vận dụng khi không tồn tại dấu hiệu được cho phép xác định rõ ràng số đội chức este trước đó.
IV.ĐIỀU CHẾ.

Bài 2. Lipit.
I. Khái niệm:Lipit là phần đa hợp hóa học hữu cơ có trong tế bào sống,không hòa tan trongnước cơ mà tan những trong dung môi hữu cơ không phân cực.II. Chất béo:1/ Khái niệm:Chất bự là trieste của glixerol với axit mập gọi thông thường là triglixerit tuyệt triaxylglixerol.



































Tổng Hợp kim chỉ nan Hóa 12 : Tổng Hợp những Dạng Giải bài Tập Kim Loại
I. Tổng hợp kim chỉ nan hóa 12: Tổng đúng theo phương pháp
1. Cách thức bảo toàn khối lượng:Tổng cân nặng các hóa học tham gia phản bội ứng bởi tổng trọng lượng các sản phầm.
Ví dụ. Trong làm phản ứng kim loại chức năng với axit → muối bột + H2
Áp dụng bảo toàn cân nặng ta có:
mdung dịch muối= mkim loại+ mdung dịch axit– m
H2
2. Phương thức tăng giảm khối lượng:
dựa vào sự tăng giảm cân nặng khi chuyển từ là 1 mol hóa học A thành 1 hoặc những mol chất B (có thể trải qua nhiều giai đoạn trung gian) ta có thể tính được số mol của những chất cùng ngược lại.
Ví dụ. Xét bội phản ứng: fe + Cu
SO4→ Fe
SO4+ Cu
Ta thấy: cứ 1 mol sắt (56 gam) tan ra thì có một mol Cu (64 gam) tạo thành, khối lượng thanh sắt kẽm kim loại tăng 64 – 56 = 8 (gam). Như vậy nếu biết được cân nặng kim nhiều loại tăng thì hoàn toàn có thể tính được số mol sắt phản ứng hoặc số mol Cu
SO4phản ứng,…
3. Phương thức sơ vật dụng dường chéo:
thường áp dụng trong các bai tập tất cả hổn hợp 2 hóa học khí, pha trộn 2 dung dịch, tất cả hổn hợp 2 muối lúc biết nồng độ xác suất của dung dịch (C%) hoặc phân tử khối vừa phải (M).
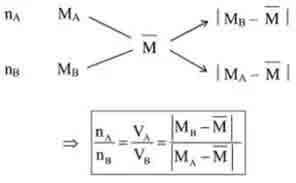
Ví dụ. Tính tỉ lệ cân nặng của 2 dung dịch bao gồm nồng độ phần trăm tương ứng là C1, C2cần mang trộn vào nhau và để được dung dịch bao gồm nồng độ C%.(C12)
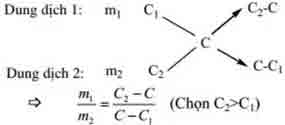
Đối với vấn đề có các thành phần hỗn hợp 2 hóa học khử, biết phân tử khối vừa phải cũng nên áp dụng phương thức sơ đồ chéo cánh để tính số mol từng khí.
4. Cách thức nguyên tử khối trung bình:trong những bài tập có hai hay các chất tất cả cùng nhân tố hóa học, bội nghịch ứng tương tự như nhau rất có thể thay chúng bởi một chất gồm công thức chung, như vậy việc thống kê giám sát sẽ rút gọn gàng được số ẩn.
– khối lượng phân tử vừa đủ của một các thành phần hỗn hợp là khối lượng của 1 mol tất cả hổn hợp đó.
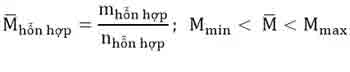
– sau thời điểm được quý giá , nhằm tính khối lượng của mỗi hóa học trong các thành phần hỗn hợp cũng áp dụng phương pháp sơ thứ chéo:
phương thức này áp dụng để giải những bài tập có rất nhiều quá trình oxi hóa khử xảy ra (nhiều bội nghịch ứng hoặc phản ứng tạo nên nhiều sản phẩm hoặc làm phản ứng qua không ít giai đoạn). Chỉ cần viết các quá trình nhường, nhận electron của các nguyên tố trong số hợp chất. Lập phương trình tổng cộng mol electron nhịn nhường = tổng số mol electron nhận.
6. Cách thức bảo toàn nguyên tố:trong những phản ứng hóa học số mol nguyên tử của các nguyên tố được bảo toàn trước cùng sau bội nghịch ứng.
Ví dụ. Xét bội nghịch ứng teo + oxit kim loại → kim loại + CO2
Bào toàn nguyên tử O: n
CO= n
CO2= n
Otrong các oxit
lúc giải các bài toán gồm phản ứng của dung dịch hỗn hợp nhiều hóa học (dung dịch bao gồm 2 axit, 2 bazo,…) để tránh viết những phương trình phản bội ứng, dễ dàng tính toán ta viết phương trình ion rút gọn.
II. Tổng hợp kim chỉ nan hóa học tập 12: Tổng đúng theo ví dụ áp dụng phương pháp
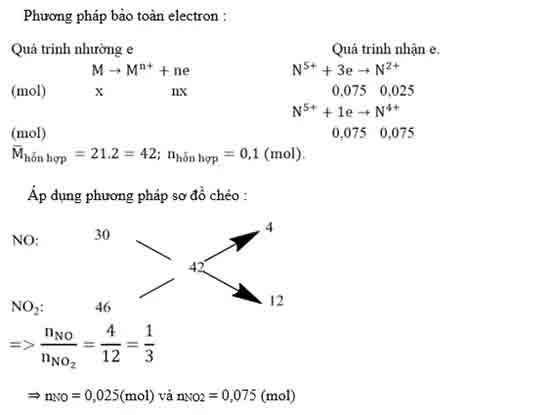
Bài 1:Hòa chảy 1,35 gam một kim loại M bằng dung dịch HNO3loãng dư nhận được 2,24 lít tất cả hổn hợp khí NO cùng NO2(đktc) tất cả tỉ khối hơi so cùng với hidro bằng 21. Kiếm tìm M.
Hướng dẫn:

Bài 2:Hòa chảy 4,59 gam nhôm trong hỗn hợp HNO31M thu được hỗn hợp X có hai khí NO với NO2, tỉ khối khá của X so với hidro bởi 16,75. Tính :
a) Thể tích mỗi khí đo làm việc đktc.
b) cân nặng muối thu đươc.
c) Thể tích hỗn hợp HNO3đã dùng.
Hướng dẫn:


III. Tổng hợp triết lý hóa học 12: tổng hợp bài tập trắc nghiệm
Bài 1:Một dung dịch tất cả chứa những ion: x mol M3+, 0,2 mol Mg2+, 0,3 mol Cu2+, 0,6 mol SO42-, 0,4 mol NO3–. Cô cạn dung nhờn này thu được 116,8 gam lếu láo hợp các muối khan. M là:A. Cr B. Fe. C. Al D. Zn
Đáp án: A
Áp dụng định nguyên lý bảo toàn năng lượng điện tích, ta có:
3x + 0,2.2 + 0,3.2 = 0,6.2 + 0,4 ⇒ x = 0,2 mol
Ta có: mmuối= m
M3++ m
Mg2++ m
Cu2++ m
SO42-+ m
NO3–
116,8 = 0,2.MM+ 0,2.44 + 0,3.64 + 0,6.96 + 0,4.62
MM= 52 ⇒ M là Cr.
Bài 2:Ngâm một chiếc đinh fe vào 200 ml dung dịch Cu
SO4. Sau khoản thời gian phản ứng kết thúc, lấy đinh ra khỏi dung dịch, rửa nhẹ, làm cho khô thấy khối lượng đinh sắt tăng thêm 0,8 gam. Tính độ đậm đặc mol của hỗn hợp Cu
SO4ban đầu.A. 1M B. 0,5M C. 0,25M D. 0,4M
Đáp án: B
Áp dụng phương pháp tăng giảm khối lượng
Theo phương trình: fe + Cu
SO4→ Cu + Fe
SO4
Cứ 1 mol fe (56 gam) công dụng với 1 mol Cu
SO4→ 1 mol Cu (64 gam).
Xem thêm: Hướng Dẫn Cách Làm Logo Trên Máy Tính, 6 Bước Thiết Kế Logo Bằng Photoshop Đơn Giản
cân nặng đinh sắt tăng: 64 – 56 = 8 (gam)
Thực tế cân nặng đinh fe tăng 0,8 (gam)
Vậy n
Cu
SO4phản ứng= 0,8/8 = 0,1(mol) và CMCu
SO4= 0,1/0,2 = 0,5M
Bài 3:Hỗn hợp bột có 3 kim loại Mg, Al, Zn có khối lượng 7,18 gam được chia làm hai phần số đông nhau. Phần 1 rước đốt cháy hoàn toàn trong oxi dư nhận được 8,71 gam hỗn hợp oxit. Phần 2 hòa tan hoàn toàn trong HNO3đặc nóng dư nhận được V lít (đktc) khí NO2(sản phẩm khử duy nhất). Hãy tính quý hiếm của V.A. 14,336l B. 11,2l C. 20,16l C. 14,72l

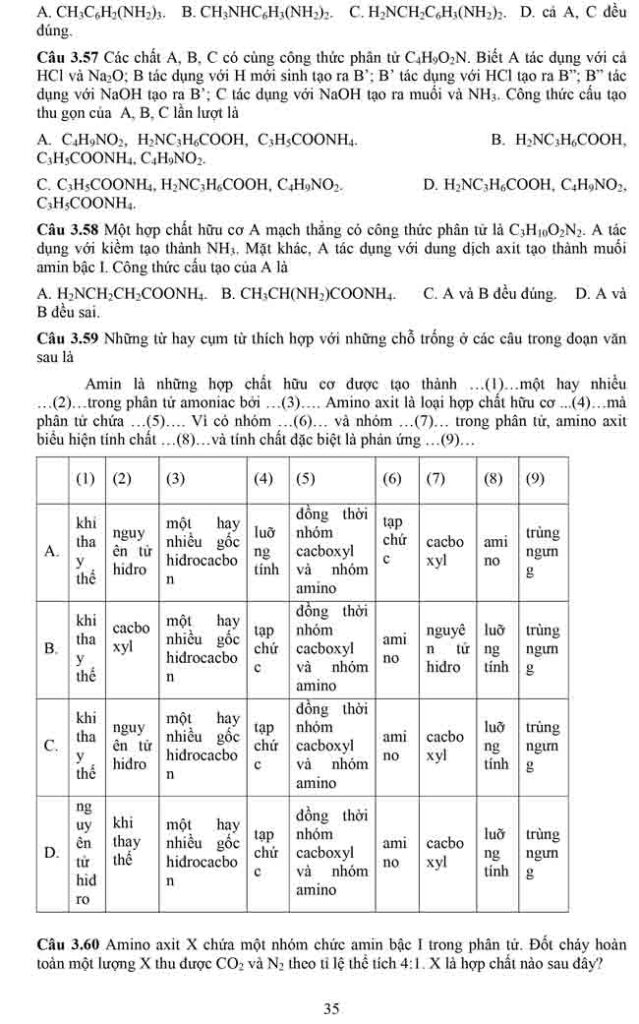
danh mục tài liệu học tập Học logic 13 Đề thi thử đại học 1498 Lớp 12 1357 Lớp 11 822 Lớp 10 828 Thi vào lớp 10 376 Lớp 9 649 Lớp 8 583 Lớp 7 639 Lớp 6 898 Thi vào lớp 6 125 Lớp 5 379 Lớp 4 338 Lớp 3 295 Lớp 2 2
Tải ứng dụng để nhận nhiều khóa học bổ trợ miễn phí tổn



Học Mãi chia sẻ tài liệu tổng hợp lý thuyết hóa 12 PDF giúp những em học sinh có một hệ thống kiến thức Hóa được tóm tắt một cách khoa học tập và không thiếu nhất, cung ứng các em trong quá trình ôn thi đại học hay ôn thi tốt nghiệp trung học phổ thông môn Hóa
I. TỔNG HỢP LÝ THUYẾT HÓA 12
Chương 1: Este - Lipit
Bài 1: Este
1. Quan niệm về dẫn xuất của axit cacbonxylic
2. Este
- quan niệm este
- Công thức tổng thể của este
- tính chất vật lí của este
- đặc thù hóa học tập của este: phản ứng thủy phân, thủy phân trong môi trường axit, thủy phân trong môi trường bazo, phản ứng của nơi bắt đầu hidrocacbon, các phản ứng thủy phân quan trọng đặc biệt của este
- Điều chế este
Bài 2: Lipit
1. Quan niệm Lipit
2. Chất béo
- Khái niệm chất béo
- tính chất vật lý của hóa học béo
- đặc điểm hóa học tập của chất béo: bội nghịch ứng thủy phân, bội nghịch ứng cùng hidro của chất béo lỏng thành chất bự rắn, phản nghịch ứng xà phòng hóa
Bài 3: tư tưởng về xà phòng và chất giặt cọ tổng hợp
1. Xà phòng:
- tư tưởng xà phòng
- phương pháp sản xuất xà phòng
2. Chất giặt rửa tổng hợp:
- Khái niệm
- phương thức sản xuất
3. Ứng dụng của xà phòng và hóa học giặt cọ tổng hợp
4. Các phản ứng hóa học thường gặp
Chương 2: Cacbonhidrat
1. Một số trong những vấn đề lý thuyết cần rứa vững
- kết cấu phân tử Glucozo cùng Fructozo; Saccarozo và Mantozo
- đặc thù vật lý
- đặc điểm hóa học
2. Một số phản ứng hóa học hay gặp
Đăng ký kết ngay khóa họcôn thi đại học môn hóa để nhấn được không hề ít ưu đại lôi kéo từ học Mãi
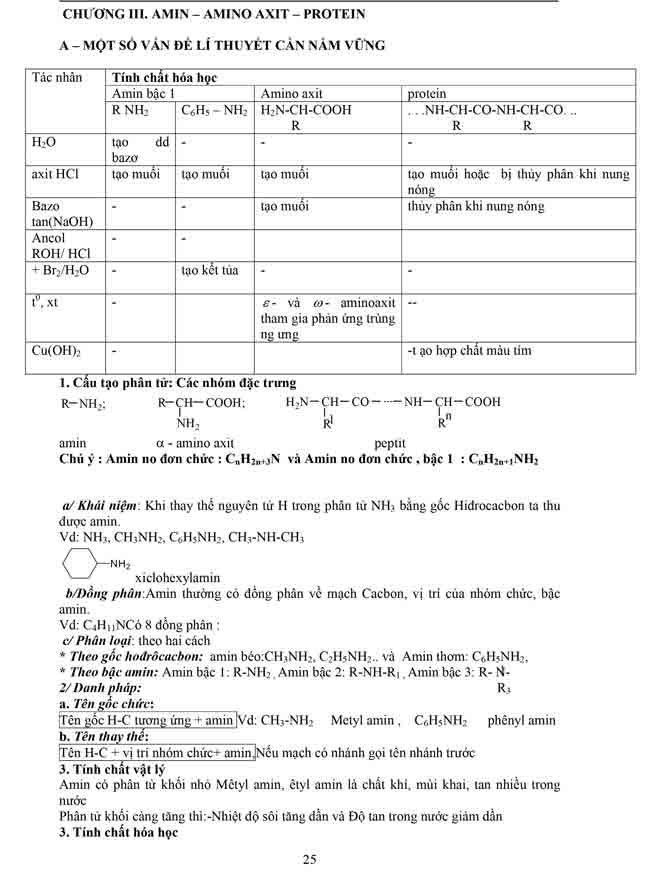
Chương 3: Amin - Amino Axit - Protein
1. Một trong những vấn đề triết lý cần cầm vững
- cấu trúc phân tử
- Danh pháp
- đặc điểm vật lý
- đặc điểm hóa học
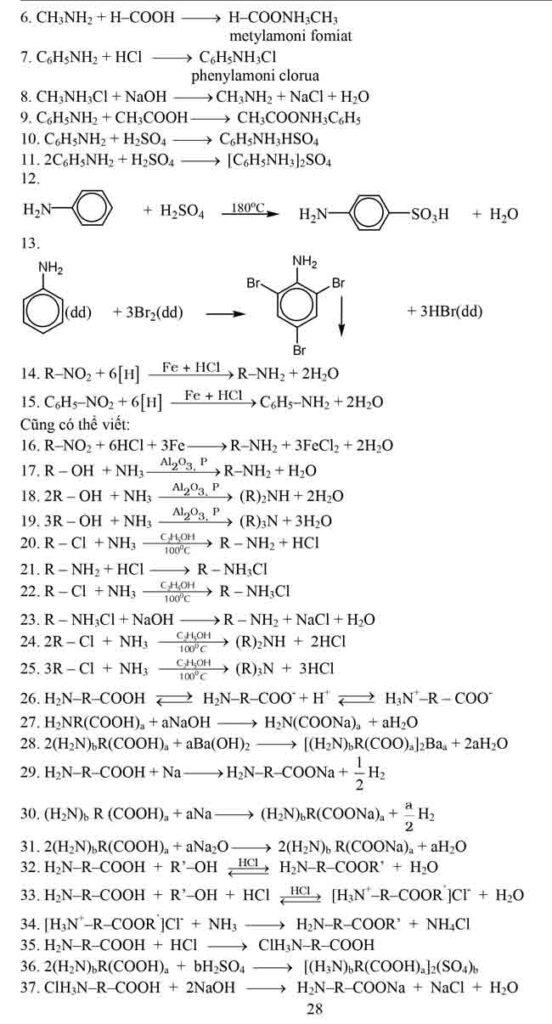
2. Một số phản ứng hóa học thường xuyên gặp
Chương 4: Polime
1. Một số trong những vấn đề định hướng Polime cần nắm vững
- khái niệm phân các loại về polime
- Phân các loại polime
- cấu tạo cấu tạo
- đặc điểm vật lí
- tính chất hóa học
2. Một số phản ứng thường xuyên gặp
II. Tổng hợp bài bác tập hóa 12
1. Bài xích tập Este - Lipit
-Bài tập cơ bản: Slide trang 6
-Bài tập nâng cao: Slide trang 12
2. Bài tập Cacbonhidrat
-Bài tập cơ bản: Slide trang 17
-Bài tập nâng cao: Slide trang 22
3. Bài tập Amin - Amino Axit - Protein
-Bài tập cơ bản: Slide trang 29
-Bài tập nâng cao: Slide trang 34
- một số trong những bài tập trường đoản cú luận: Slide trang 38
4. Bài tập Polime
-Bài tập cơ bản: Slide trang 44
-Bài tập nâng cao: Slide trang 46
Trên đó là Tổng hợp toàn cục kiến thức
Hóa 12 ôn thi đại học, mong muốn với tài liệu này sẽ cung cấp chocác em học viên nắm được hồ hết kiến thức định hướng và kỹ năng làm bài quan trọng cho kỳ thi xuất sắc nghiệp thpt môn Hóa chuẩn bị tới.